2025.10.28
臨床級臍帶間質幹細胞外泌體之臨床前與首次人體試驗:用於膝關節炎之關節內治療
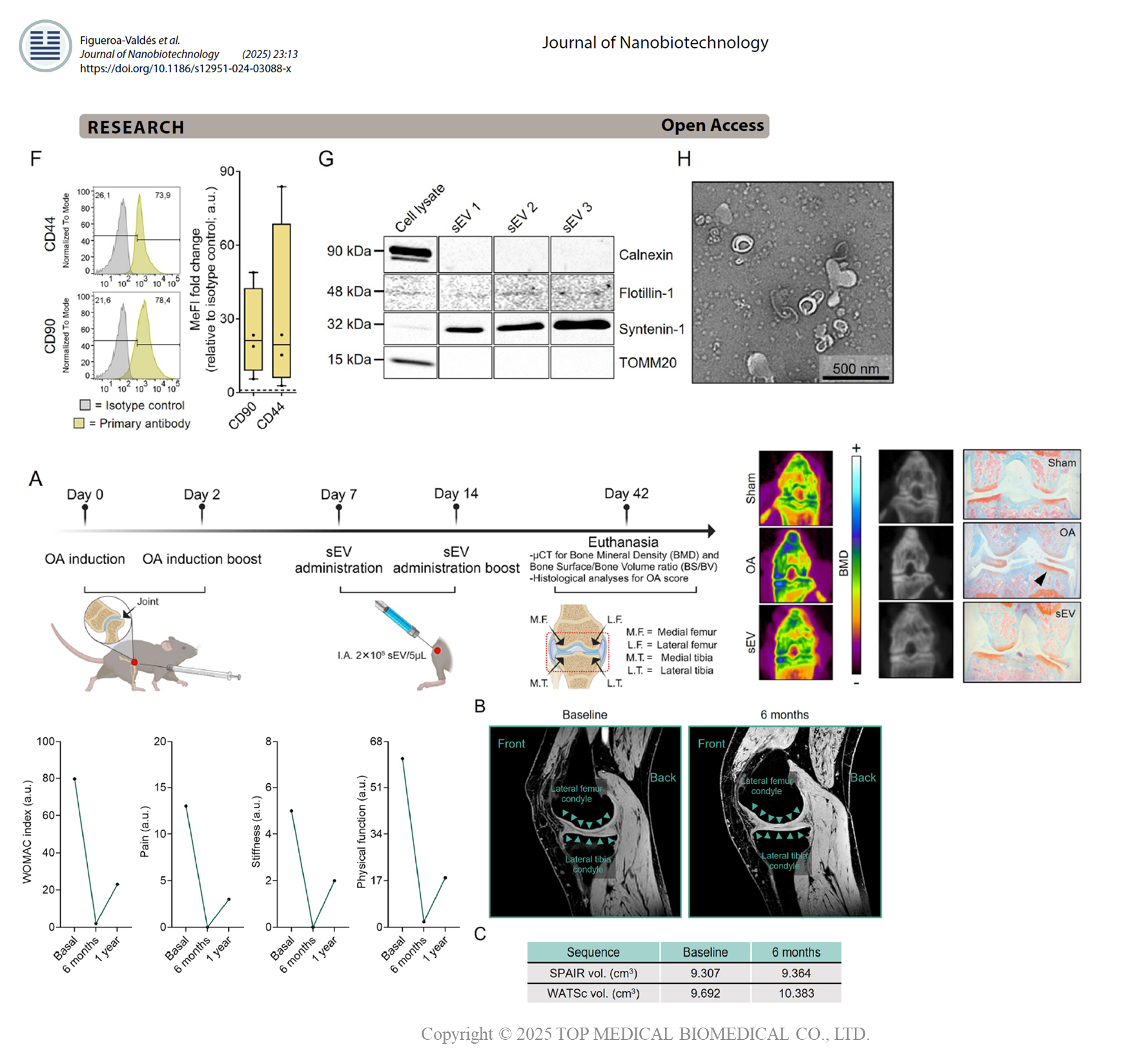
研究目的
本研究旨在膝關節退化性關節炎(Osteoarthritis, OA)提出使用臍帶間質幹細胞來源所分泌的小型胞外囊泡(sEV)作為臨床等級的製劑。在首次人體試驗,結果顯示單次關節內注射臍帶MSC-EVs對膝骨關節炎患者是安全、耐受性良好且可行的,並觀察到初步的疼痛減輕與功能改善訊號:
- 開發符合臨床規格(clinical-grade)可製造且可重複生產的 UC-MSC-sEV
- 在大鼠或小鼠的骨關節炎模型(如前十字韌帶切斷術誘導)中,進行關節內注射EVs,
- 在首次人體試驗中
一、開發符合臨床規格(clinical-grade)可製造且可重複生產的 UC-MSC-sEV
-
符合細胞囊泡的定義:尺寸(149.4 nm)、濃度(1.22 ×10¹¹)、表面標誌(CD63 > CD81 > CD9)、蛋白與 miRNA等內容。
-
免疫調節:將EVs與發炎狀態下的人類軟骨細胞或巨噬細胞共培養後,HLA-DR、CD86 表現下降,CD206、CD163 表現上升,表示從促發炎的M1表型往M2b表型極化。伴隨IL-10、TNFα、IL-6等細胞因子變化。
-
軟骨細胞保護:在氧化壓力試驗中,80.6%細胞死亡的情況下,sEV處理後降至57.2%死亡。
-
安定性試驗:存放於-80°C經過24月後,粒子數約降至原1/3數量,其它參數影響不大。
二、在大鼠或小鼠的骨關節炎模型(如前十字韌帶切斷術誘導)中,進行關節內注射EVs
-
動物模型:注射 2×10⁸ particles/knee,於42天後μCT結果顯示骨密度(BMD)接近sham群;OARSI分數明顯低於OA控制群。
-
生物分佈:DiR標記sEV在關節內24-72h保留,並無轉移至其它器官。
三、在首次人體試驗中
-
研究對象:招募患有輕至中度膝骨關節炎、對常規治療反應不佳的患者。
-
設計為 Phase I 安全性試驗:單臂、開放性標籤、單次關節內注射sEV (2×1010)。
-
在首例(56歲女性膝OA)IA 給藥後,6個月與12個月追蹤未見嚴重不良事件(SAE);活動能力與疼痛/功能量表改善(如WOMAC、VAS)等報告。
-
雖然為早期研究但動物數據與人體初步數據皆支持其「抗炎+保護軟骨」潛力,相關設計尚未達到大規模隨機對照的試驗條件。
資料出處:Journal of Nanobiotechnology volume 23, Article number: 13 (2025)
本公司業務洽詢
歡迎來信泰美緹康:topmedical@bio-nin.com 或填寫表單,我們將會與您連繫。